مقدمه: آشنایی با عنصر قلع
قلع، با نماد شیمیایی Sn و عدد اتمی ۵۰، یک عنصر فلزی نقرهای-سفید، چکشخوار و نسبتاً نرم است که در گروه ۱۴ جدول تناوبی جای میگیرد. این عنصر به عنوان یک فلز پسا-واسطه (post-transition metal) طبقهبندی میشود.
این طبقهبندی صرفاً یک نامگذاری نیست، بلکه به طور عمیقی بر ویژگیهای فیزیکی و شیمیایی غیرمعمول آن تأثیر میگذارد. فلزات پسا-واسطه، برخلاف فلزات واسطه سنتی، اغلب دارای نقطه ذوب پایینتر و نرمی بیشتری هستند. این خصوصیات به وضوح در قلع مشاهده میشود؛ نقطه ذوب آن حدود ۲۳۲ درجه سانتیگراد است و سختی آن در مقیاس موهس تنها ۱.۵ است.
این نرمی، چکشخواری و شکلپذیری بالا، قابلیت کارکرد استثنایی قلع را فراهم میآورد که برای کاربردهای حیاتی آن در آلیاژسازی و پوششدهی سطوح ضروری است. قلع به صورت عنصری، یعنی متشکل از تنها یک نوع اتم، وجود دارد و نمیتواند به مواد سادهتر تجزیه شود.
نماد شیمیایی Sn از کلمه لاتین stannum مشتق شده است. عدد اتمی ۵۰ نشاندهنده وجود ۵۰ پروتون در هسته هر اتم قلع است. اتمهای قلع معمولاً حدود ۶۹ نوترون دارند که فراوانترین ایزوتوپ آن (¹¹⁹Sn) دارای عدد جرمی ۱۱۹ است. عدد اتمی ۵۰ برای قلع در فیزیک هستهای یک “عدد جادویی” محسوب میشود.
این مفهوم به تعداد پروتونها یا نوترونهایی اشاره دارد که منجر به پایداری فوقالعاده هسته اتمی میشوند، مشابه لایههای الکترونی کامل در شیمی. این پایداری هستهای منحصر به فرد، قلع را قادر میسازد تا ۱۰ ایزوتوپ پایدار داشته باشد، که بیشترین تعداد ایزوتوپ پایدار در بین تمام عناصر شناخته شده در جدول تناوبی است. این ویژگی بنیادی، قلع را از نظر هستهای متمایز میکند و به درک پایداری و فراوانی نسبی آن در طبیعت کمک میکند.
ویژگیهای فیزیکی قلع
قلع به دلیل مجموعهای از ویژگیهای فیزیکی متمایز، کاربردهای گستردهای در صنایع مختلف پیدا کرده است.
ظاهر، رنگ و حالت فیزیکی
قلع خالص در دمای اتاق به صورت یک جامد فلزی نقرهای-سفید، براق و با قابلیت پرداخت بالا ظاهر میشود. این فلز ممکن است کمی ته رنگ آبی نیز داشته باشد. ظاهر جذاب و قابلیت پرداخت بالای آن، قلع را برای کاربردهای تزئینی و پوششدهی سطوح ایدهآل ساخته است.

نقطه ذوب، نقطه جوش و چگالی
یکی از مهمترین ویژگیهای فیزیکی قلع، نقطه ذوب نسبتاً پایین آن برای یک فلز است که حدود ۲۳۱.۹ تا ۲۳۲ درجه سانتیگراد (۴۴۹.۶ درجه فارنهایت) گزارش شده است. این ویژگی، عامل اصلی بسیاری از کاربردهای تاریخی و مدرن قلع است. در دوران باستان، نقطه ذوب پایین قلع به متالورژیستها اجازه داد تا آن را به راحتی با قرار دادن سنگ معدن در آتش ذوب کنند. این سهولت در ذوب و ترکیب با مس، آغازگر عصر برنز شد، که اولین انقلاب تکنولوژیکی بزرگ بشر محسوب میشود.
در عصر مدرن، نقطه ذوب پایین قلع برای فرآیندهای صنعتی حیاتی است؛ به عنوان مثال، در صنعت الکترونیک، این ویژگی برای لحیمکاری ضروری است، جایی که قلع مذاب به عنوان “چسبی که بیشتر دنیای الکتریکی ما را در کنار هم نگه میدارد” عمل میکند و اتصالات الکتریکی بین سیمها را ایجاد میکند. همچنین، در فرآیند تولید شیشه شناور (float glass process)، شیشه مذاب روی حمامی از قلع مذاب ریخته میشود تا سطحی کاملاً صاف و یکنواخت ایجاد شود.
این فرآیند، که در دهه ۱۹۵۰ متحول شد، به دلیل نیاز به یک فلز با نقطه ذوب پایین که بتواند حمامی پایدار برای شیشه مذاب فراهم کند، به قلع وابسته است. این نشاندهنده چگونگی تأثیر یک ویژگی فیزیکی ظاهراً ساده بر کل رشتههای صنعتی و پیشرفتهای تکنولوژیکی است.
نقطه جوش قلع نیز در حدود ۲۲۷۰ تا ۲۶۰۲ درجه سانتیگراد قرار دارد. چگالی قلع بسته به شکل آلوتروپیک آن متفاوت است: قلع سفید (β-tin) حدود ۷.۳۱ گرم بر سانتیمتر مکعب و قلع خاکستری (α-tin) حدود ۵.۷۵ گرم بر سانتیمتر مکعب چگالی دارد.
سختی، چکشخواری و شکلپذیری
قلع فلزی نسبتاً نرم است و سختی آن در مقیاس موهس (Mohs) حدود ۱.۵ است. این فلز بسیار چکشخوار (malleable) است، به این معنی که میتوان آن را به راحتی به ورقهای نازک تبدیل کرد. همچنین، قلع شکلپذیر (ductile) است و میتوان آن را به سیمهای نازک کشید. ترکیب نرمی، چکشخواری و شکلپذیری قلع، آن را به یک فلز بسیار قابل کار تبدیل کرده است. این قابلیت کارکرد، برای استفاده از آن در آلیاژها بسیار مهم است، زیرا قلع این خواص را به سایر فلزات منتقل میکند و قابلیت شکلدهی و پردازش آنها را افزایش میدهد.
به عنوان مثال، در آلیاژهایی مانند برنز، پیوتر و بابیت، قلع نقش حیاتی در بهبود خواص مکانیکی و کارپذیری ایفا میکند. همچنین، این ویژگیها برای کاربرد آن به عنوان یک پوشش محافظ (مانند تینپلیت) ضروری است، زیرا به آن اجازه میدهد تا به اشکال مختلف قالبگیری شود و سطوح را به طور یکنواخت بپوشاند و مقاومت به خوردگی را افزایش دهد. این مجموعه از خواص فیزیکی، قلع را به یک ماده مهندسی بسیار ارزشمند تبدیل کرده است که امکان انطباق آن با اشکال مختلف و افزایش خواص سایر فلزات در هنگام آلیاژسازی را فراهم میکند.
رسانایی الکتریکی و حرارتی
قلع رسانایی الکتریکی و حرارتی خوبی دارد. اگرچه رسانایی آن کمتر از مس یا نقره است، اما برای کاربرد در قطعات الکترونیکی و لحیمکاری مؤثر است. رسانایی الکتریکی قلع، به ویژه در ترکیب با نقطه ذوب پایین آن، آن را برای لحیمکاری ضروری میسازد و به عنوان “چسبی که بیشتر دنیای الکتریکی ما را در کنار هم نگه میدارد” عمل میکند.
این ترکیب از ویژگیها امکان ایجاد اتصالات الکتریکی پایدار و کارآمد را فراهم میکند. علاوه بر این، قلع در دماهای پایینتر از ۳.۷۲ کلوین (K) به یک ابررسانا تبدیل میشود. این قابلیت ابررسانایی، اگرچه کاربرد گستردهای در دمای اتاق ندارد، اما پتانسیل قلع را در فناوریهای پیشرفته و تحقیقات مواد نشان میدهد. به عنوان مثال، آلیاژ نیوبیوم-قلع (niobium-tin alloy) در ساخت آهنرباهای ابررسانا استفاده میشود. این خواص الکتریکی قلع، از اتصالات الکترونیکی روزمره (لحیمکاری) تا کاربردهای بسیار تخصصی و پیشرفته (مانند آهنرباهای ابررسانا)، طیف وسیعی از کاربردها را در مهندسی برق و فیزیک به نمایش میگذارد.
جدول ۱: خواص فیزیکی کلیدی قلع
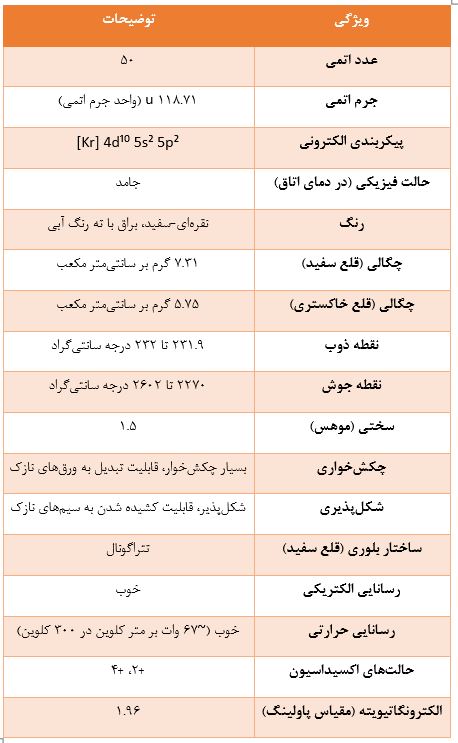
این جدول به عنوان یک مرجع سریع و متمرکز برای خواص فیزیکی و برخی خواص شیمیایی کلیدی قلع عمل میکند. این سازماندهی اطلاعات پراکنده در منابع مختلف را تسهیل میکند و به خوانندگان، به ویژه کسانی که به دنبال دادههای خاص هستند، امکان میدهد تا به سرعت به مقادیر مورد نظر دست یابند. این ساختار همچنین به مقایسه مستقیم ویژگیها کمک کرده و وضوح کلی گزارش را افزایش میدهد.

آلوتروپهای قلع و پدیده آفت قلع
قلع، مانند برخی دیگر از عناصر، در اشکال آلوتروپیک مختلفی وجود دارد که دارای ساختار بلوری و خواص فیزیکی متفاوتی هستند. دو آلوتروپ اصلی قلع شامل قلع سفید (β-tin) و قلع خاکستری (α-tin) هستند.
قلع سفید (بتا) و قلع خاکستری (آلفا)
- قلع سفید (β-tin): این شکل از قلع، حالت فلزی، چکشخوار و پایدار قلع در دمای اتاق است. قلع سفید دارای ساختار بلوری تتراگونال (tetragonal) است و چگالی آن ۷.۳۱ گرم بر سانتیمتر مکعب است.۲ این آلوتروپ همان شکلی است که در اکثر کاربردهای صنعتی و تجاری قلع مشاهده میشود.
- قلع خاکستری (α-tin): این آلوتروپ، شکل غیرفلزی و شکننده قلع است که در دماهای پایینتر از ۱۳ درجه سانتیگراد پایدار میشود. به طور خاص، برخی منابع پایداری ساختاری آن را در دمای ۲۷۳- درجه سانتیگراد ذکر میکنند. قلع خاکستری دارای ساختار بلوری مکعبی الماسی (diamond cubic) است. به دلیل ماهیت کووالانسی پیوندهای اتمهای آن در این ساختار، الکترونها نمیتوانند آزادانه حرکت کنند، بنابراین قلع خاکستری فاقد خواص فلزی است و به صورت مادهای پودری و کدر-خاکستری ظاهر میشود.
تفاوتهای ساختاری و خواص
تفاوت اصلی بین این دو آلوتروپ در ساختار بلوری و خواص آنها نهفته است. قلع سفید به دلیل ساختار فلزی خود، رسانای خوب الکتریسیته و گرما است و از انعطافپذیری بالایی برخوردار است. در مقابل، قلع خاکستری به دلیل ساختار کووالانسی، شکننده و غیرفلزی است و رسانایی الکتریکی ندارد.
پدیده آفت قلع و اهمیت تاریخی آن
پدیده “آفت قلع” (Tin Pest یا Tin Disease) زمانی رخ میدهد که قلع سفید در دماهای حدود ۱۳ درجه سانتیگراد یا کمتر، به طور خودبهخودی به قلع خاکستری تبدیل میشود. این تغییر فاز میتواند منجر به تخریب کامل اشیاء ساخته شده از قلع شود، زیرا قلع خاکستری پودری و شکننده است و باعث متلاشی شدن ساختار فلزی میشود. این پدیده به دلیل تغییر حجم قابل توجهی که در طول تبدیل رخ میدهد، میتواند باعث ترکخوردگی و فروپاشی مواد شود.
اهمیت تاریخی این پدیده در چندین واقعه مستند شده است. یکی از مشهورترین آنها، فاجعه لشکرکشی رابرت اسکات به قطب جنوب در سال ۱۹۱۲ است. دانشمندان معتقدند که بسیاری از وسایل حاوی قلع در این مأموریت، از جمله دکمههای ژاکت و ظروف غذای قلعی، به دلیل سرمای شدید به قلع خاکستری تبدیل شده و شکننده شدهاند. این تبدیل به پودر شدن و از بین رفتن وسایل کمک کرده و به شکست مأموریت اسکات دامن زده است.
نکته مهم این است که مقادیر ناچیزی از ناخالصیها مانند آنتیموان، بیسموت، مس، سرب، نقره یا طلا، که معمولاً در قلع تجاری وجود دارند، میتوانند این واکنش را مهار کنند و قلع سفید را در دماهای پایینتر نیز پایدار نگه دارند. این امر توضیح میدهد که چرا آفت قلع در محصولات مدرن کمتر مشاهده میشود، زیرا قلع خالص به ندرت در کاربردهای تجاری مورد استفاده قرار میگیرد. درک این پدیده برای حفظ آثار تاریخی و طراحی مواد برای محیطهای سرد بسیار حیاتی است.
ویژگیهای شیمیایی قلع
قلع به عنوان یک فلز پسا-واسطه، دارای ویژگیهای شیمیایی خاصی است که آن را برای کاربردهای متنوعی مناسب میسازد. در دمای اتاق، قلع نسبتاً غیرفعال است و یک لایه اکسیدی محافظ روی سطح خود تشکیل میدهد که از اکسیداسیون بیشتر جلوگیری میکند.

واکنشپذیری با هوا، آب، اسیدها و بازها
- واکنشپذیری با هوا: قلع در شرایط عادی به سرعت با هوا واکنش نمیدهد. با این حال، در حضور گرما، قلع با اکسیژن واکنش داده و دیاکسید قلع (SnO₂) تشکیل میدهد: Sn(s) + O₂(g) → SnO₂(s). این لایه اکسیدی محافظ، مقاومت قلع در برابر خوردگی را افزایش میدهد.
- واکنشپذیری با آب: قلع در شرایط عادی با آب واکنش نمیدهد. اما در معرض بخار آب، این عنصر با آب واکنش داده و دیاکسید قلع و هیدروژن تولید میکند: Sn(s) + 2 H₂O(g) → SnO₂(s) + 2 H₂(g).
- واکنشپذیری با اسیدها: قلع به راحتی توسط اسیدهای قوی مورد حمله قرار میگیرد، اگرچه معمولاً با اسیدهای ضعیف واکنش نمیدهد.
- با اسید کلریدریک (HCl) قوی، قلع کلرید قلع (II) و هیدروژن تولید میکند: Sn(s) + 2 HCl(aq) → SnCl₂(s) + H₂(g).۳ این واکنش آهسته است و برای تسریع آن معمولاً نیاز به گرما دارد.
- واکنش با اسید نیتریک به دما و غلظت اسید بستگی دارد. اسید نیتریک رقیق آمونیوم نیترات و نیترات قلع (II) تولید میکند، در حالی که اسید غلیظتر دیاکسید قلع (SnO₂) یا اسید استانیک (H₂SnO₃) همراه با دیاکسید نیتروژن سمی تولید میکند.
- در آب سلطانی (aqua regia)، قلع به سرعت واکنش داده و به کلرید قلع (IV) اکسید میشود: 4HCl + 2HNO₃ + Sn → NO₂ + NO + SnCl₄ + 3H₂O.
- واکنشپذیری با بازها: قلع به راحتی توسط بازهای قوی مورد حمله قرار میگیرد. به عنوان مثال، در حضور محلول قوی قلیایی، قلع با هیدروکسید سدیم واکنش داده و نمکهای هیدروکسیاستانات سدیم (IV) و گاز هیدروژن تولید میکند: Sn + 2 NaOH + 4 H₂O → Na₂ + ۲ H₂.
حالتهای اکسیداسیون و مقاومت به خوردگی
قلع عمدتاً در دو حالت اکسیداسیون +۲ (استانوس) و +۴ (استانیک) وجود دارد. حالت ۴+ کمی پایدارتر است. قلع عنصری به راحتی در محلول اسیدی به یون ۲+ اکسید میشود و این ترکیب میتواند با عوامل اکسیدکننده ملایم به یون ۴+ تبدیل شود.۳ این دو حالت اکسیداسیون به قلع اجازه میدهند تا ترکیبات معدنی و آلی متنوعی را تشکیل دهد.
مقاومت قلع در برابر خوردگی، آن را به عنصری بسیار مفید تبدیل کرده است. این ویژگی باعث میشود قلع به عنوان یک پوشش محافظ برای سایر فلزات، مانند آهن و فولاد در قوطیهای کنسرو، استفاده شود تا از زنگزدگی و خوردگی جلوگیری کند. اگرچه پوشش اکسیدی آن کاملاً ضد اکسیژن نیست، اما نرخ خوردگی آن در شرایط ملایم پایین است.۲ قلع همچنین میتواند به عنوان کاتالیزور عمل کند و سرعت واکنشهای شیمیایی را در محلولهای حاوی اکسیژن افزایش دهد.
ایزوتوپها و ترکیبات
قلع دارای ۱۰ ایزوتوپ پایدار است که بیشترین تعداد در بین تمام عناصر است، و همچنین ۲۹ ایزوتوپ ناپایدار و ۳۰ ایزومر شبهپایدار دارد. فراوانترین ایزوتوپ پایدار، قلع-۱۲۰ است که تقریباً یک سوم کل قلع طبیعی را تشکیل میدهد.
قلع ترکیبات شیمیایی متنوعی را تشکیل میدهد:
- ترکیبات معدنی: قلع هالیدهایی در هر دو حالت اکسیداسیون ۲+ و ۴+ تشکیل میدهد (مانند SnF₄، SnCl₄، SnBr₄، SnI₄ برای Sn(IV) و SnF₂، SnCl₂، SnBr₂، SnI₂ برای Sn(II)). هالیدهای قلع (IV) دارای هندسه مولکولی چهاروجهی هستند. کلرید قلع (II) (کلرید استانوس) یک هالید قلع مهم تجاری است که به عنوان عامل کاهنده و ماده رنگزا در نساجی استفاده میشود. دیاکسید قلع (SnO₂) نیز یک اکسید مهم است که آمفوتری (هم خاصیت اسیدی و هم بازی دارد) و در سرامیکها و حسگرهای گاز کاربرد دارد.
- ترکیبات آلی قلع (استانانها): این ترکیبات حداقل یک پیوند کووالانسی قلع-کربن (Sn-C) دارند و از نظر تجاری بسیار مفید هستند. آنها بر اساس تعداد گروههای آلی به مونومر، دایمر، تریمر و تتراارگانوتین طبقهبندی میشوند. برخی از ترکیبات آلی قلع بسیار سمی هستند و به عنوان بیوسید (آفتکش) استفاده شدهاند. اکثر آنها مایعات یا جامدات بیرنگ هستند، در برابر هوا و آب پایدارند و هندسه چهاروجهی دارند.

تاریخچه قلع: از عصر برنز تا مدرن
تاریخچه قلع به طور جداییناپذیری با پیشرفتهای تکنولوژیکی بشر گره خورده است، از تمدنهای باستان تا دوران صنعتی و صنایع مدرن. این فلز، که شاید در نگاه اول “خاکستری و بیاهمیت” به نظر برسد، در واقع شالوده اولین انقلاب تکنولوژیکی بزرگ بشر بوده است.
اولین کاربردها در تمدنهای باستان (عصر برنز)
قلع برای اولین انقلاب تکنولوژیکی بشر، یعنی عصر برنز، حیاتی بود. بیش از ۵۰۰۰ سال پیش (حدود ۳۰۰۰ سال قبل از میلاد)، متالورژیستها کشف کردند که ترکیب قلع و مس، آلیاژی به نام برنز را ایجاد میکند که بسیار سختتر و بادوامتر از هر یک از این فلزات به تنهایی است. نکته مهم این بود که برنز میتوانست لبهای تیز را حفظ کند، که برای ساخت ابزار و سلاح بسیار حیاتی بود. این کشف منجر به جایگزینی گسترده سلاحها و ابزارهای سنگی با نمونههای برنزی شد و عصر برنز را آغاز کرد.
اولین اشیاء برنزی حاوی کمتر از ۲ درصد قلع یا آرسنیک بودند و تصور میشود که نتیجه آلیاژسازی ناخواسته به دلیل وجود فلزات کمیاب در سنگ معدن مس بودهاند. برنز آرسنیکی ابتدا در خاورمیانه ظاهر شد، جایی که آرسنیک معمولاً با سنگ معدن مس یافت میشود. اما خطرات بهداشتی آرسنیک به سرعت درک شد و جستجو برای منابع سنگ معدن قلع، که بسیار کمخطرتر بود، در اوایل عصر برنز آغاز شد. اهمیت قلع برای موفقیت فرهنگهای عصر برنز و کمیابی این منبع، بینشهایی را در مورد شبکههای تجاری و تعاملات فرهنگی آن دوران ارائه میدهد و به همین دلیل کانون مطالعات باستانشناسی فشرده بوده است.
منابع و مسیرهای تجاری باستانی قلع:
منابع باستانی قلع کمیاب بودند و این فلز معمولاً باید از فواصل بسیار طولانی برای تأمین تقاضا در مناطقی که فاقد ذخایر قلع بودند، معامله میشد.
- کمربند قلع جنوب شرقی آسیا: این کمربند از یوننان در چین تا شبهجزیره مالایا کشیده شده است. ذخایر یوننان از حدود ۷۰۰ سال قبل از میلاد استخراج شدند و تا سلسله هان به منبع اصلی قلع در چین تبدیل گشتند.
- اروپا: اروپا منابع قلع بسیار کمی دارد.
- کورنوال و دوون (بریتانیا): این مناطق در طول دوران باستان منابع مهمی برای اروپا و مدیترانه بودند. شواهدی از تجارت قلع کورنوال با شرق مدیترانه در اواخر عصر برنز وجود دارد.
- برتانی (فرانسه): منابع قابل توجهی در برتانی پس از فتح گال توسط رومیان (حدود ۵۰ سال قبل از میلاد) به طور گسترده مورد بهرهبرداری قرار گرفتند و در طول دوره قرون وسطی نیز اهمیت خود را حفظ کردند.
- کوههای اوره (آلمان/جمهوری چک): ادعا میشود که قلع برای اولین بار در حدود ۲۵۰۰ سال قبل از میلاد در اینجا استخراج شده و دانش آن حدود ۲۰۰۰ سال قبل از میلاد به برتانی و کورنوال گسترش یافته است.
- شبهجزیره ایبری (اسپانیا/پرتغال): قلع ایبری در عصر برنز به طور گسترده در سراسر مدیترانه معامله میشد و توسط رومیان به طور گسترده مورد بهرهبرداری قرار گرفت.
- آسیا (غربی، مرکزی، شمالی و شبهقاره هند): غرب آسیا ذخایر قلع بسیار کمی دارد، اما معدن کاستریت کستل در جنوب ترکیه از ۳۲۵۰ تا ۱۸۰۰ سال قبل از میلاد مورد استفاده قرار گرفته است. در آسیای مرکزی، ذخایر در ازبکستان، تاجیکستان و افغانستان از حدود ۲۰۰۰ سال قبل از میلاد بهرهبرداری شدهاند.۱۱ در شمال آسیا، ذخایر در سیبری شرقی دور توسط فرهنگ سیما-توربینو و فرهنگهای شمالی چین در حدود ۲۰۰۰ سال قبل از میلاد استفاده میشدند. شبهقاره هند نیز از قلع بین ۱۵۰۰ تا ۱۰۰۰ سال قبل از میلاد استفاده میکرد، اما به دلیل ذخایر پراکنده و کوچک، به واردات وابسته بود.
- آفریقا: رگههای غنی قلع در آفریقای مرکزی و جنوبی وجود دارد، اما بهرهبرداری باستانی از آنها مورد بحث است. فرهنگ بانتو در زیمبابوه بین قرون ۱۱ تا ۱۵ میلادی به طور فعال قلع را استخراج، ذوب و تجارت میکرد.
- قاره آمریکا: ذخایر کوچکی در پرو، کلمبیا، برزیل و آرژانتین و ذخایر عمدهای در شمال بولیوی وجود دارد. این ذخایر از حدود ۱۰۰۰ سال پس از میلاد توسط فرهنگهای آند، از جمله امپراتوری اینکا، برای برنز قلع بهرهبرداری میشدند. در آمریکای شمالی، تنها منبع قابل بهرهبرداری شناخته شده در دوران باستان، استان قلع زاکاتکاس در شمال مرکزی مکزیک بود که قلع مورد نیاز فرهنگهای غرب مکزیک را برای تولید برنز تأمین میکرد.
مسیرهای تجاری: به دلیل پراکندگی ذخایر قلع در سراسر جهان و ماهیت ضروری آن برای تولید برنز قلع، تجارت قلع نقش مهمی در توسعه فرهنگها در طول دوران باستان ایفا کرد. باستانشناسان با استفاده از متون تاریخی، کاوشهای باستانشناسی و تجزیه و تحلیل عناصر کمیاب و ایزوتوپهای سرب، بخشهایی از شبکههای تجاری گسترده فرهنگهای باستانی را بازسازی کردهاند. کشتیهای غرق شدهای مانند اولوبورون (۱۳۰۰ سال قبل از میلاد) در سواحل ترکیه، که حاوی بیش از ۳۰۰ شمش مس و حدود ۴۰ شمش قلع بود، شواهدی از تجارت گسترده قلع در مدیترانه را نشان میدهد.
نقش در عصر صنعتی و پس از آن
حتی پس از گذار از برنز به آهن و ظهور عصر صنعتی، قلع اهمیت خود را در فرهنگ بشر حفظ کرد.
- پیوتر (Pewter): قلع جزء اصلی پیوتر بود، آلیاژی که با ترکیب قلع با مقادیر کمی مس، آنتیموان، بیسموت یا گاهی سرب ساخته میشد. پیوتر به عنوان جایگزینی مقرون به صرفه برای طلا و نقره عمل میکرد.۷ با این حال، محبوبیت پیوتر – و در نتیجه قلع – با تولید انبوه ظروف چینی ارزانقیمت در قرن ۱۸ به سرعت کاهش یافت.
- قوطیهای “قلعی”: در قرن ۱۹، قلع کاربرد جدیدی در قوطیهای “قلعی” یافت. اگرچه این قوطیها عمدتاً از آهن یا فولاد ساخته میشدند، اما با لایه نازکی از قلع پوشانده میشدند تا آهن را از زنگزدگی، نقطه ضعف اصلی آن، محافظت کنند. امروزه، بسیاری از قوطیها دیگر از قلع استفاده نمیکنند و به جای آن از پوششهای پلاستیکی یا آلومینیوم استفاده میشود.
- کاربردهای تاریخی قلع خالص: کاربردهای تاریخی قلع خالص شامل وسایل روشنایی مانند فانوسهای سوراخدار، محافظهای شمع، شمعدانهای دیواری و قاب آینهها بود.
تحولات مهم مدرن
سفر قلع با بشر با کشف کاربردهای جدید و متنوع برای این فلز همهکاره ادامه یافت.
- صنعت الکترونیک: صنعت الکترونیک در حال حاضر بزرگترین مصرفکننده مدرن قلع است. قلع به عنوان “چسبی که بیشتر دنیای الکتریکی ما را در کنار هم نگه میدارد” عمل میکند، عمدتاً به شکل لحیم (solder). لحیم، که در اثر حرارت ذوب میشود، اتصالات الکتریکی بین سیمها را ایجاد میکند. نقطه ذوب پایین و عدم سمیت آن، خواص منحصر به فردی هستند که آن را برای این منظور ایدهآل میسازند. آلیاژهای قلع مانند لحیم نرم، برنز، پیوتر و برنز فسفر از اهمیت بالایی برخوردارند.
- ترکیبات آلی قلع: در حالی که قلع خالص سمی نیست، برخی ترکیبات آلی قلع میتوانند بسیار سمی باشند. این ترکیبات، که به طور طبیعی وجود ندارند، به طور گستردهای به عنوان قارچکش و حشرهکش استفاده شدهاند. یک نوع بحثبرانگیز، تریبوتیلتین (tributyl-tin)، در رنگهای ضد خزه برای جلوگیری از رشد خزه و صدف روی بدنه کشتیها استفاده میشد که سرعت کشتیها را کاهش داده و مصرف سوخت را به شدت افزایش میداد. با وجود اثربخشی، این رنگهای مبتنی بر قلع آسیبهای جدی به محیط زیست دریایی وارد کردند، به طوری که حتی غلظتهای بسیار کم نیز اثرات بیولوژیکی مخربی داشتند. در نتیجه، سازمان بینالمللی دریانوردی استفاده از آنها را در محیط دریایی در سال ۲۰۰۸ ممنوع کرد. یک ترکیب مرتبط برای تثبیت پلیوینیل کلراید (PVC) استفاده میشود و از تغییر رنگ و شکننده شدن آن در هنگام گرم شدن برای قالبگیری به محصولاتی مانند لولههای زهکشی جلوگیری میکند.
- صنعت شیشه (فرآیند شیشه شناور): صنعت شیشه یکی دیگر از مصرفکنندگان قابل توجه قلع است، به لطف یک روش انقلابی تولید شیشه که در بریتانیا در دهه ۱۹۵۰ توسعه یافت. این نوآوری، معروف به “فرآیند شیشه شناور” (float glass process)، شامل ریختن شیشه مذاب روی حمامی از قلع مذاب بود. این فرآیند، که توسط تیمی از جمله شیمیدان تد فلچر در شرکت پیلکینگتون (Pilkington) تکمیل شد، ساخت شیشه را از یک فرآیند داغ، کثیف، خطرناک و پرزحمت (نورد شیشه مذاب روی صفحات فولادی) متحول کرد. فرآیند شیشه شناور یک ریسک بزرگ برای پیلکینگتون بود اما در نهایت با موفقیت همراه شد و میلیونها دلار از طریق راهاندازی کارخانهها و مجوزهای عملیاتی در سراسر جهان برای این شرکت به ارمغان آورد. امروزه، تقریباً ۸۰ درصد از شیشه ورقهای جهان با استفاده از این روش تولید میشود.
تولید جهانی قلع: استخراج و پالایش
قلع عمدتاً از کانی کاسیتریت (SnO₂)، یک اکسید طبیعی قلع که حاوی حدود ۷۸.۸ درصد قلع است، استخراج میشود. ذخایر اقتصادی کاسیتریت به چند منطقه جغرافیایی محدود میشوند. مهمترین این مناطق در جنوب شرقی آسیا قرار دارد که شامل مناطق معدنی قلع چین، میانمار، تایلند، مالزی و اندونزی میشود. برزیل، استرالیا، نیجریه و کنگو نیز از دیگر تولیدکنندگان عمده هستند. حدود ۸۰ درصد قلع جهان از ذخایر آبرفتی یا ثانویه تأمین میشود.
روشهای استخراج و تغلیظ:
روشهای اصلی استخراج قلع بسته به نوع ذخیره (اولیه یا ثانویه) متفاوت است:
- ذخایر آبرفتی (Placer Deposits): این ذخایر، که در بستر رودخانههای باستانی یا درهها انباشته شدهاند، رایجترین منبع قلع هستند.
- لایروبی با سطل (Bucket-line Dredging): روش اصلی برای استخراج ذخایر بزرگ قلع آبرفتی است.۱۴ در این فرآیند، آبرفت حاوی قلع توسط زنجیرهای پیوسته از سطلها حفاری و به داخل لایروب منتقل میشود، جایی که شسته شده و به صورت تقریبی تغلیظ میشود.
- پمپاژ شن (Gravel Pumping): به ویژه در جنوب شرقی آسیا، برای ذخایر کوچکتر یا آنهایی که برای لایروبی مناسب نیستند (مانند بستر سنگی ناهموار)، از پمپاژ شن استفاده میشود. در این روش، آبرفت توسط جتهای آب با فشار بالا خرد شده و دوغاب حاصل به واحد تغلیظ پمپ میشود.
- ذخایر رگهای و پراکنده (Vein and Disseminated Deposits): این ذخایر کمتر رایج هستند و معمولاً در سازندهای گرانیتی یافت میشوند. استخراج آنها با استفاده از روشهای معدنکاری زیرزمینی سختسنگ، مشابه سایر سنگهای معدن فلزات غیرآهنی مانند روی، انجام میشود. سنگ معدن با حفاری و انفجار خرد شده و سپس به کارخانه فرآوری منتقل میشود تا خرد و آسیاب شود.
فرآیند تغلیظ:
پس از استخراج اولیه، دوغاب غنی از کاسیتریت تحت فرآیندهای تغلیظ بیشتری قرار میگیرد که عمدتاً شامل روشهای جداسازی گرانشی است. این روشها شامل عبور دوغاب از تجهیزاتی مانند جیگها، مارپیچها یا میزهای لرزان است که کاسیتریت سنگین را از کانیهای سبکتر مانند کوارتز، فلدسپات و میکا جدا میکند. ناخالصیهای کانیهای سنگینتر ناخواسته، مانند اکسیدهای آهن، سپس با استفاده از جداسازی مغناطیسی یا الکترواستاتیکی جدا میشوند. محصول نهایی این فرآیند تغلیظ، یک کنسانتره کاسیتریت است که معمولاً حاوی حدود ۷۰ درصد قلع است. کنسانترههای حاصل از ذخایر رگهای معمولاً عیار پایینتری (حدود ۵۰ درصد قلع) دارند، به دلیل اندازه دانه ریز کاسیتریت و دشواری در حذف تمام کانیهای سولفیدی مرتبط.
ذوب و پالایش:
ذوب (Smelting): قبل از ذوب، کنسانترههای کمعیار از سنگهای معدن پیچیده ابتدا در کوره بازتابشی یا چندطبقهای در دماهای بین ۵۵۰ تا ۶۵۰ درجه سانتیگراد (۱۰۲۵ تا ۱۲۰۰ درجه فارنهایت) برشته میشوند تا گوگرد از بین برود. بسته به نوع و کمیت ناخالصیها، واکنشهای اکسیدکننده، کاهنده یا کلرزنی رخ میدهند. برشتهکاری اغلب با شستشو با آب یا محلولهای اسیدی دنبال میشود تا ناخالصیهای محلول شده حذف شوند.
کورههای ذوب قلع از سه نوع اصلی هستند: کورههای بازتابشی، کورههای بلند یا کورههای الکتریکی. این عملیات معمولاً به صورت دستهای انجام میشود. اصل ذوب قلع، کاهش شیمیایی اکسید قلع با حرارت دادن آن با کربن برای تولید فلز قلع و گاز دیاکسید کربن است.
در یک فرآیند بازتابشی معمولی (که رایجترین است)، کوره به مدت حدود ۱۵ ساعت تا دمای ۱۳۰۰ تا ۱۴۰۰ درجه سانتیگراد (۲۳۷۵ تا ۲۵۵۰ درجه فارنهایت) گرم میشود و در طول آن به طور مکرر هم زده میشود. این فرآیند منجر به تشکیل حوضچهای از قلع مذاب میشود که لایهای از سرباره حاوی بیشتر ناخالصیهای ناخواسته روی آن شناور است. پس از اتمام ذوب، قلع ناخالص خارج شده و به صورت اسلبهای بزرگ ریختهگری میشود.
پالایش (Refining): دو روش اصلی برای پالایش قلع ناخالص وجود دارد:
- پالایش با آتش (Fire Refining): این روش رایجتر است و قلع با خلوص تا ۹۹.۸۵ درصد تولید میکند که برای کاربردهای تجاری عمومی مناسب است.
- جوشاندن (Boiling): در این روش، قلع ناخالص از کوره ذوب یا کوره ذوب انتخابی در ظروف یا کتریها گرم میشود. هوای فشرده برای هم زدن قلع مذاب استفاده میشود که باعث اکسید شدن ناخالصیها و بالا آمدن آنها به سطح و تشکیل سرباره میشود.
- ذوب انتخابی (Liquation): این روش برای تصفیه قلع ناخالص و سرباره حاصل از ذوب استفاده میشود. این فرآیند ناخالصیهایی را که نقطه ذوب بالاتری نسبت به قلع دارند، حذف میکند. مواد مورد تصفیه روی یک کوره شیبدار در کوره بازتابشی قرار داده شده و تا دمایی کمی بالاتر از نقطه ذوب قلع گرم میشوند. قلع به آرامی ذوب شده و به پایین شیب جریان مییابد تا در یک ظرف جمعآوری شود، در حالی که باقیماندههای ذوب نشده روی کوره باقی میمانند.
- تقطیر وکیوم (Vacuum Distillation): گاهی اوقات در پالایش با آتش استفاده میشود. در این فرآیند، قلع مذاب در یک ظرف گرافیتی متراکم در دماهای بالا (۱۱۰۰ تا ۱۳۰۰ درجه سانتیگراد) گرم میشود. وکیوم اعمال میشود و ناخالصیها با تقطیر انتخابی در دماهای جوش مربوطه خود حذف میشوند.
- پالایش الکترولیتی (Electrolytic Refining): این روش برای محصولات حاصل از سنگهای معدن پیچیده و برای تولید قلع با خلوص بسیار بالا (تا ۹۹.۹۹۹ درصد) استفاده میشود. در این فرآیند، قلع ناخالص به صورت آند ریختهگری میشود و در یک الکترولیت اسیدی قرار میگیرد، همراه با کاتدهای اولیه ساخته شده از ورقههای نازک قلع با خلوص بالا.
قلع ثانویه: منابع مهم قراضه قلع شامل یاتاقانهای مستعمل، آلیاژهای لحیم و برنزها هستند. اغلب، تولید مستقیم آلیاژها از این قراضههای حاوی قلع اقتصادیتر از بازیافت قلع با خلوص بالا است. قلع از قراضه تینپلیت نیز بازیافت میشود، که به صورت الکترولیتی قلعزدایی میشود تا قلع با خلوص بالا و قراضه فولاد تمیز تولید شود.

ملاحظات زیستمحیطی و بهداشتی قلع
قلع، اگرچه یک فلز غیرضروری برای بدن است، اما بسته به شکل آن، میتواند یک آلاینده زیستمحیطی مهم با اثرات بهداشتی مختلف باشد. این عنصر به طور طبیعی در اشکال معدنی و آلی وجود دارد و به طور گسترده در صنایع استفاده میشود.
انتشار و سرنوشت زیستمحیطی:
قلع میتواند از منابع طبیعی و انسانساز به محیط زیست آزاد شود. فرسایش و فعالیتهای کشاورزی میتوانند قلع و ترکیبات معدنی قلع را از خاک آزاد کنند. تولید و استفاده صنعتی از قلع و ترکیبات آن نیز به انتشار آن در محیط زیست کمک میکند. به طور کلی، قلع در محیط زیست نسبتاً غیرمتحرک در نظر گرفته میشود.
ترکیبات آلی قلع عمدتاً از طریق تولید و استفاده آنها آزاد میشوند. به عنوان مثال، تریبوتیلتین و تریفنیلتین مستقیماً از طریق استفاده در رنگهای ضد خزه و به عنوان آفتکشها وارد محیط زیست میشوند. مقادیر کمتری از ترکیبات آلی قلع ممکن است از محصولات مصرفی نشت کنند یا از طریق دفع محصولات حاوی آنها در محلهای دفن زباله آزاد شوند. این ترکیبات معمولاً در خاکها و رسوبات تقسیم میشوند.
مسیرهای مواجهه انسانی و منابع:
مواجهه انسانی با قلع میتواند از طریق استنشاق، بلع یا جذب پوستی رخ دهد. جذب پوستی به ویژه برای مواجهه شغلی با برخی ترکیبات آلی قلع قابل توجه است.
متوسط مصرف روزانه قلع برای یک فرد بالغ در ایالات متحده حدود ۴.۰۰۳ میلیگرم تخمین زده میشود، که ۴ میلیگرم آن از غذا و ۰.۰۰۳ میلیگرم از هوا تأمین میشود، با سطوح غیرقابل تشخیص از آب آشامیدنی. مهمترین منبع مواجهه با قلع، غذا، به ویژه محصولات غذایی کنسرو شده است.
قوطیهای قلعاندود شده برای بستهبندی مواد غذایی، اصلیترین عامل مصرف قلع از طریق رژیم غذایی هستند. غلظت قلع در غذاها بسته به اینکه در قوطیهای قلعاندود شده با لاک یا بدون لاک بستهبندی شدهاند، متفاوت است. امروزه، بیش از ۹۰ درصد قوطیهای قلعاندود شده برای غذا لاکدار هستند.
سمیت قلع و اثرات بهداشتی
قلع معدنی:
اکثر ترکیبات قلع معدنی به دلیل حلالیت پایین و جذب ضعیف از طریق خوراکی، غیرسمی در نظر گرفته میشوند. با این حال، سمیت قلع معدنی با حالت اکسیداسیون آن مرتبط است؛ نمکهای قلع دوظرفیتی سمیتر از نمکهای چهارظرفیتی هستند. مواجهه با نمکهای قلع دوظرفیتی میتواند منجر به تحریک دستگاه گوارش، درد شکمی و کمخونی شود. قلع معدنی تمایل به تجمع در ریهها دارد، زیرا جذب نمیشود و نامحلول است، بنابراین ریهها به عنوان اندام هدف عمل میکنند.
مواجهه مزمن با قلع معدنی (مانند گرد و غبار یا دود اکسید استانیک) میتواند منجر به شکلی خوشخیم از پنوموکونیوز به نام استانوزیس (stannosis) شود که عمدتاً سیستم تنفسی تحتانی را درگیر میکند. بر اساس مطالعات موجود در انسان، شواهدی مبنی بر تأثیر قلع معدنی بر تولید مثل یا رشد، یا اینکه یک نوروتوکسین، ایمونوتوکسین، جهشزا یا سرطانزا در انسان باشد، وجود ندارد.
ترکیبات آلی قلع (Organotins):
ترکیبات آلی قلع عموماً سمیتر از قلع معدنی هستند و عمدتاً توسط انسان ساخته میشوند. در محیط زیست، یونهای قلع معدنی میتوانند تحت آلکیلاسیون بیولوژیکی قرار گیرند، عمدتاً بیومتیلاسیون (biomethylation)، تا ترکیبات آلی قلع سمیتر را تشکیل دهند. این فرآیند بیومتیلاسیون به چرخهزیستی قلع کمک میکند و فراریت، سمیت و تحرک آن را افزایش میدهد.
سمیت ترکیبات آلی قلع بسته به طول زنجیره آلکیل آنها متفاوت است. ترکیبات آلکیلتین با زنجیره کوتاه به خوبی از دستگاه گوارش جذب میشوند، در حالی که ترکیبات با زنجیره بلند به خوبی جذب نمیشوند. ترکیبات آلی قلع لیپوفیلیک هستند، که اثرات موضعی و سیستمیک آنها را توضیح میدهد. آنها میتوانند به غشاهای سلولی و میتوکندری نفوذ کرده و آسیب برسانند، فسفوریلاسیون اکسیداتیو را مختل کنند و سنتز هم اکسیژناز را مهار کنند.۱۲ آنها همچنین به عنوان ایمونوتوکسیک و ژنوتوکسیک شناخته میشوند.
- اثرات عصبی: موارد مرگ و میر پس از مواجهه حاد استنشاقی با مخلوطی از بخارات تریمتیلتین و دیمتیلتین و پس از بلع حاد خوراکی تریمتیلتین گزارش شده است. افراد آسیبدیده علائم و نشانههای عصبی مانند سردرد، ترس از نور، تغییر هوشیاری و تشنج را نشان دادند. تریاتیلتینها و تریمتیلتینها قویترین نوروتوکسینها در میان ترکیبات آلی قلع هستند.
- اختلال غدد درونریز: ترکیبات آلی قلع به عنوان مواد شیمیایی مختلکننده غدد درونریز (endocrine-disrupting chemicals) در نظر گرفته میشوند. مطالعات نشان دادهاند که ترکیبات آلی قلع میتوانند با تأثیر بر رونویسی و سنتز هورمونهای استروئیدی، اختلال غدد درونریز و سمیت تولید مثلی را در ماهیها ایجاد کنند. به عنوان مثال، سایهگزاتین (CYT)، یک آفتکش آلی قلع، اثرات سمی رشدی را در لارو ماهی زبرا با اختلال در سیستم غدد درونریز ایجاد کرده است.
ممنوعیتهای زیستمحیطی:
به دلیل تأثیر منفی آنها بر اکوسیستمهای ساحلی، تریبوتیلتین، تریفنیلتین و مشتقات آنها، که در فرمولاسیون رنگهای ضد خزه استفاده میشدند، به طور قطعی ممنوع شدهاند.
منابع انسانساز قلع در محیط زیست شامل سوزاندن سوختهای فسیلی، سوزاندن زباله و تولید قلع، ترکیبات آلی قلع، آهن، فولاد و فلزات غیرآهنی است. این فعالیتهای انسانساز به طور قابل توجهی قلع بیشتری را نسبت به منابع طبیعی به جو آزاد میکنند. ورودیهای زیستمحیطی بیشتر از استفاده گسترده از پلیوینیل کلراید (PVC) که حاوی ترکیبات مونو و دیارگانوتین به عنوان تثبیتکننده است، حاصل میشود.
نتیجهگیری
قلع، با نماد Sn و عدد اتمی ۵۰، عنصری با تاریخچهای غنی و ویژگیهای منحصربهفرد است که نقش محوری در پیشرفتهای تکنولوژیکی بشر ایفا کرده است. از آغاز عصر برنز، جایی که نقطه ذوب پایین و قابلیت آلیاژسازی آن با مس، برنز را به اولین آلیاژ مهم بشر تبدیل کرد، تا دوران مدرن که در صنعت الکترونیک به عنوان لحیم و در تولید شیشه به عنوان بستر فرآیند شیشه شناور به کار میرود، قلع همواره یک ماده حیاتی بوده است.
خواص فیزیکی قلع، از جمله نقطه ذوب پایین، نرمی، چکشخواری و شکلپذیری بالا، آن را به فلزی بسیار قابل کار تبدیل کرده است که به راحتی میتواند به اشکال مختلف درآید و خواص مطلوب را به آلیاژها منتقل کند. رسانایی الکتریکی و حرارتی خوب آن نیز، به ویژه در ترکیب با نقطه ذوب پایین، برای کاربردهای الکترونیکی ضروری است. از نظر شیمیایی، قلع در دو حالت اکسیداسیون ۲+ و ۴+ وجود دارد و مقاومت خوبی در برابر خوردگی نشان میدهد، که آن را برای پوششدهی محافظ ایدهآل میسازد. پدیده آلوتروپیک “آفت قلع” نیز، اگرچه در گذشته چالشهایی ایجاد کرده، اما با درک علمی و افزودن ناخالصیهای مهارکننده، در کاربردهای مدرن کنترل شده است.
فرآیندهای استخراج و پالایش قلع، از معدنکاری آبرفتی و رگهای گرفته تا ذوب و پالایش پیچیده، نشاندهنده تلاشهای مهندسی برای بهرهبرداری از این منبع ارزشمند است. با این حال، استفاده گسترده از قلع، به ویژه ترکیبات آلی قلع، نگرانیهای زیستمحیطی و بهداشتی را به همراه داشته است. در حالی که قلع معدنی نسبتاً کمخطر تلقی میشود، ترکیبات آلی قلع میتوانند سمی باشند و اثرات نامطلوبی بر سیستم عصبی، ایمنی و غدد درونریز داشته باشند، که منجر به ممنوعیت برخی از آنها در کاربردهای خاص شده است.
در مجموع، قلع نمونهای برجسته از یک عنصر شیمیایی است که با ویژگیهای فیزیکی و شیمیایی خاص خود، نه تنها تاریخ تکنولوژی بشر را شکل داده، بلکه همچنان در قلب نوآوریهای صنعتی و الکترونیکی مدرن قرار دارد. درک جامع از خواص، تاریخچه، فرآیندهای تولید و ملاحظات زیستمحیطی و بهداشتی آن، برای استفاده مسئولانه و پایدار از این فلز همهکاره ضروری است.

