جدول تناوبی عناصر، که اغلب به عنوان سنگ بنای علم شیمی شناخته میشود، یک سیستم سازماندهی قدرتمند است که تمام عناصر شیمیایی شناخته شده را بر اساس خواصشان مرتب میکند. این جدول نه تنها به عنوان یک فهرست ساده از عناصر عمل میکند، بلکه چارچوبی اساسی برای درک رفتار ماده و پیشبینی خواص مواد جدید فراهم میآورد.
تاریخچه این جدول به تلاشهای پیشگامانه دانشمند روسی، دیمیتری مندلیف، در سال ۱۸۶۹ بازمیگردد. مندلیف با تنظیم عناصر بر اساس وزن اتمی، توانست الگوهای تکرارشونده در خواص آنها را شناسایی کند و حتی وجود عناصری که هنوز کشف نشده بودند را پیشبینی نماید.
این مقاله با هدف ارائه یک منبع جامع و سئو شده در مورد جدول تناوبی، به بررسی چیستی آن، تاریخچه تکامل، ساختار تفصیلی، دستهبندی عناصر، روندهای تناوبی خواص و اهمیت آن در علم شیمی و فراتر از آن میپردازد.
جدول تناوبی چیست؟
جدول تناوبی عناصر، که با نام جدول مندلیف نیز شناخته میشود، ساختاری دقیق و کامل است که تمامی عناصر کشف شده را طبق یک نظم مشخص معرفی میکند.
این جدول، عناصر را بر اساس افزایش عدد اتمی آنها، که برابر با تعداد پروتونهای موجود در هسته اتم است، از چپ به راست و به صورت ردیفی مرتب میکند. سازماندهی عناصر بر اساس عدد اتمی، برخلاف پیشنهاد اولیه مندلیف که بر مبنای وزن اتمی بود، برخی از ناسازگاریها را برطرف کرده و بازتاب دقیقتری از قانون تناوبی ارائه میدهد.
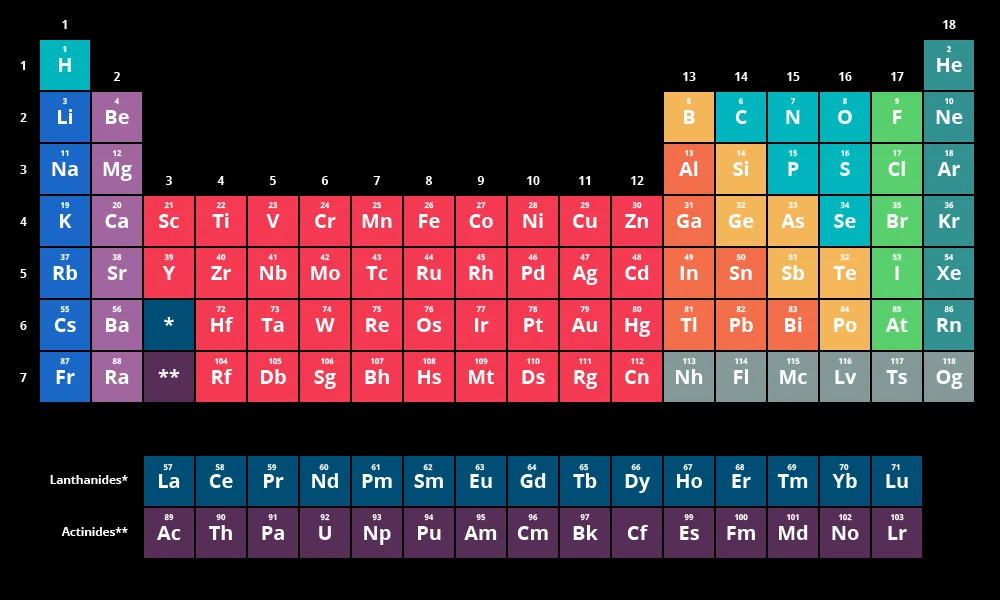
ساختار کلی جدول تناوبی شامل ۱۸ ستون عمودی به نام گروه یا خانواده و ۷ ردیف افقی به نام دوره یا تناوب است. این آرایش تصادفی نیست؛ بلکه الگوهای تکرارشونده در خواص شیمیایی عناصر را منعکس میکند.
عناصر موجود در یک گروه به دلیل داشتن تعداد الکترونهای ظرفیت یکسان، خواص شیمیایی مشابهی دارند. به طور کلی، عناصر در جدول تناوبی به سه دسته اصلی تقسیم میشوند: فلزات، نافلزات و شبهفلزات. این دستهبندی گسترده به درک تفاوتهای اساسی در خواص و رفتار عناصر کمک میکند.
تاریخچه تکامل جدول تناوبی
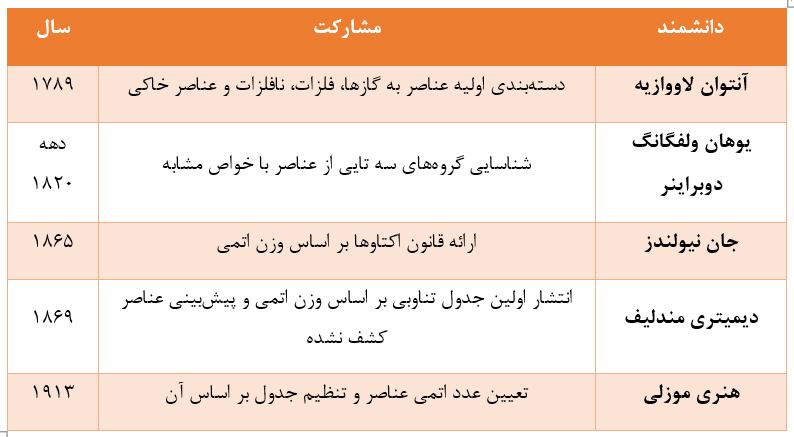
تلاش برای طبقهبندی عناصر شیمیایی به دوران قبل از مندلیف بازمیگردد. در سال ۱۷۸۹، آنتوان لاووازیه، عناصر شناخته شده آن زمان را به چهار دسته گازها، فلزات، نافلزات و عناصر خاکی تقسیم کرد. اگرچه این دستهبندی اولیه بود، اما گامی مهم در جهت سازماندهی دانش شیمی محسوب میشد.
در دهههای بعد، دانشمندانی مانند یوهان ولفگانگ دوبراینر با شناسایی گروههای سه تایی از عناصر با خواص مشابه و جان نیولندز با ارائه قانون اکتاوها بر اساس وزن اتمی، تلاشهایی را برای یافتن الگو در خواص عناصر انجام دادند. این تلاشها، هرچند کامل نبودند، اما الگوهای تکرارشونده در خواص عناصر را برجسته ساختند و راه را برای پیشرفتهای بعدی هموار کردند.
نقطه عطف در تاریخچه جدول تناوبی، انتشار جدول دیمیتری مندلیف در سال ۱۸۶۹ بود. نبوغ مندلیف در این بود که او عناصر را بر اساس وزن اتمی مرتب کرد و به طور حیاتی، جاهای خالی را برای عناصری که هنوز کشف نشده بودند باقی گذاشت.
او حتی توانست خواص این عناصر پیشبینینشده را با دقت قابل توجهی تخمین بزند. مندلیف با بررسی روندهای تناوبی عناصر شناخته شده در اطراف این خانههای خالی، توانست خواصی مانند وزن اتمی، چگالی، نقطه ذوب و نقطه جوش آنها را تخمین بزند.
پیشبینیهای او، مانند پیشبینی خواص عناصر اکا-بور، اکا-آلومینیوم و اکا-سیلیسیم که بعدها به ترتیب به نامهای اسکاندیم، گالیم و ژرمانیم کشف شدند، دلیل اصلی پذیرش جدول او در جامعه علمی بود.
پس از مندلیف، دانشمندان دیگری نیز نقش مهمی در تکمیل و اصلاح جدول تناوبی ایفا کردند. در سال ۱۹۱۳، هنری موزلی با استفاده از اشعه ایکس نشان داد که عدد اتمی، نه وزن اتمی، مبنای مناسبتری برای تنظیم عناصر در جدول است.
کار موزلی باعث رفع برخی از ناهماهنگیهای موجود در جدول مندلیف شد و درک دقیقتری از قانون تناوبی ارائه داد. علاوه بر مندلیف و موزلی، دانشمندان دیگری مانند لاووازیه، دوبراینر، نیولندز و سیبورگ نیز سهم قابل توجهی در درک و سازماندهی عناصر داشتهاند.
برای مثال، نیلز بور وجود عنصری شبیه به زیرکونیم را پیشبینی کرد که بعدها به نام هافنیم کشف شد. جدول زیر برخی از دانشمندان برجسته و مشارکتهای آنها در تاریخچه جدول تناوبی را نشان میدهد:
ساختار تفصیلی جدول تناوبی
جدول تناوبی عناصر از دورهها (ردیفهای افقی) و گروهها (ستونهای عمودی) تشکیل شده است.
دورهها (تناوبها)
جدول تناوبی شامل ۷ دوره است. عناصر موجود در یک دوره، تعداد لایههای الکترونی یکسانی دارند. با حرکت در طول یک دوره از چپ به راست، عدد اتمی عناصر افزایش مییابد و خواص آنها به تدریج تغییر میکند. به طور کلی، با حرکت از چپ به راست در یک دوره، خاصیت فلزی کاهش و خاصیت نافلزی، الکترونگاتیوی و انرژی یونش افزایش مییابد.
برای مثال، در دوره دوم، عناصری مانند لیتیم (یک فلز واکنشپذیر)، بریلیم، بور، کربن، نیتروژن، اکسیژن، فلوئور (یک نافلز بسیار واکنشپذیر) و نئون (یک گاز نجیب بیاثر) قرار دارند که خواص آنها به طور چشمگیری تغییر میکند.
گروهها (خانوادهها)
جدول تناوبی دارای ۱۸ گروه است. عناصر موجود در یک گروه به دلیل داشتن تعداد الکترونهای ظرفیت یکسان، خواص شیمیایی مشابهی دارند. برخی از گروهها نامهای خاصی دارند که نشاندهنده ویژگیهای مشترک آنها است. به عنوان مثال، گروه ۱ به عنوان فلزات قلیایی شناخته میشود که عناصری براق و نرم هستند و به شدت با آب واکنش میدهند.
گروه ۲ به عنوان فلزات قلیایی خاکی شناخته میشود که در لایه خارجی خود دو الکترون دارند و واکنشپذیری کمتری نسبت به فلزات قلیایی نشان میدهند. گروه ۱۷ به عنوان هالوژنها شناخته میشود که عناصر غیرفلزی بسیار واکنشپذیر با ۷ الکترون ظرفیت هستند و به شدت با فلزات قلیایی واکنش داده و نمکهای یونی تشکیل میدهند.
گروه ۱۸ به عنوان گازهای نجیب شناخته میشود که عناصر غیرفلزی گازی با ۸ الکترون ظرفیت (به جز هلیوم با ۲ الکترون) هستند و به دلیل پر بودن لایه خارجی الکترونی خود، واکنشپذیری بسیار کمی دارند.
بلوکهای جدول تناوبی
علاوه بر دورهها و گروهها، جدول تناوبی به چهار بلوک نیز تقسیم میشود: s، p، d و f. این بلوکها بر اساس زیرلایهای که آخرین الکترون عنصر در آن قرار دارد، تعیین میشوند. بلوک s در سمت چپ جدول قرار دارد و شامل گروههای ۱ و ۲ و عناصر هیدروژن و هلیوم است.
بلوک p در سمت راست جدول قرار دارد و شامل گروههای ۱۳ تا ۱۸ است. بلوک d در وسط جدول قرار دارد و شامل گروههای ۳ تا ۱۲ است که به عنوان فلزات واسطه شناخته میشوند. بلوک f در پایین جدول قرار دارد و شامل دو ردیف لانتانیدها و اکتینیدها است که به عنوان فلزات واسطه داخلی نیز شناخته میشوند. آرایش الکترونی عناصر به طور مستقیم تعیین میکند که در کدام گروه و بلوک قرار میگیرند.

دستهبندی عناصر و ویژگیهای آنها
عناصر جدول تناوبی را میتوان بر اساس خواصشان به سه دسته اصلی تقسیم کرد: فلزات، نافلزات و شبهفلزات.
فلزات
فلزات مانند مس و آلومینیوم بیشتر عناصر جدول تناوبی را تشکیل میدهند و معمولاً در سمت چپ و مرکز جدول قرار دارند (به جز هیدروژن). موقعیت فلزات در جدول نشاندهنده تمایل آنها به از دست دادن الکترون و تشکیل یونهای مثبت است. فلزات دارای ویژگیهای فیزیکی و شیمیایی مشخصی هستند، از جمله رسانایی الکتریکی و حرارتی بالا، چکشخواری (قابلیت تبدیل شدن به ورقههای نازک)، براقیت و معمولاً جامد بودن در دمای اتاق (به جز جیوه).
این خواص ناشی از وجود الکترونهای غیرمتمرکز در ساختار شبکه فلزی است که امکان حرکت آسان بار الکتریکی و تغییر شکل را فراهم میکند. گروههای مختلف فلزات شامل فلزات قلیایی (گروه ۱) که بسیار واکنشپذیر هستند، فلزات قلیایی خاکی (گروه ۲) که واکنشپذیری کمتری دارند، فلزات واسطه (گروههای ۳-۱۲) که دارای حالات اکسیداسیون متغیر و ترکیبات رنگی هستند، و لانتانیدها و اکتینیدها (عناصر بلوک f) که خواص منحصر به فردی دارند، میشوند. هر گروه از فلزات بر اساس آرایش الکترونی خود، روندهای خاصی در واکنشپذیری و خواص نشان میدهد.
نافلزات
نافلزات معمولاً در سمت راست و بالای جدول تناوبی قرار دارند. موقعیت آنها نشاندهنده تمایلشان به گرفتن الکترون و تشکیل یونهای منفی است. نافلزات دارای ویژگیهای فیزیکی و شیمیایی متفاوتی نسبت به فلزات هستند. آنها معمولاً رسانای ضعیف جریان الکتریکی و گرما هستند، در حالت جامد معمولاً کدر و شکننده هستند و میتوانند به صورت جامد (مانند کربن و فسفر)، مایع (برم) یا گاز (مانند اکسیژن و نیتروژن) در دمای اتاق وجود داشته باشند.
این تنوع در حالت فیزیکی و رسانایی ضعیف ناشی از ماهیت پیوند و آرایش الکترونی آنها است. گروههای مهم نافلزات شامل هالوژنها (گروه ۱۷) که بسیار واکنشپذیر هستند و گازهای نجیب (گروه ۱۸) که واکنشپذیری بسیار کمی دارند، و همچنین سایر نافلزات مانند اکسیژن (ضروری برای تنفس)، نیتروژن (جز اصلی جو) و کربن (اساس شیمی آلی) میشوند. هر گروه از نافلزات رفتار و واکنشپذیری مشخصی از خود نشان میدهد.
شبهفلزات
شبهفلزات عناصری هستند که خواصی بین فلزات و نافلزات دارند و معمولاً در امتداد خط مورب بین فلزات و نافلزات در جدول تناوبی قرار میگیرند. موقعیت میانی آنها نشاندهنده خواص انتقالی آنها بین فلزات و نافلزات است. شبهفلزات دارای ویژگیهای فیزیکی و شیمیایی هستند که هم به فلزات و هم به نافلزات شباهت دارند. آنها ممکن است ظاهری فلزی داشته باشند اما شکننده باشند و معمولاً نیمهرسانا هستند.
توانایی آنها در عمل به عنوان نیمهرسانا، آنها را در ساخت وسایل الکترونیکی بسیار مهم کرده است. عناصر شبهفلز شامل بور، سیلیسیم، ژرمانیم، آرسنیک، آنتیموان، تلوریم، پولونیوم و گاهی استاتین میشوند. طبقهبندی دقیق برخی از این عناصر ممکن است مورد بحث باشد (مانند پولونیوم و استاتین)، که نشاندهنده انتقال تدریجی خواص در جدول تناوبی است.
روندهای تناوبی خواص عناصر
یکی از جنبههای قدرتمند جدول تناوبی، وجود روندهای قابل پیشبینی در خواص عناصر با حرکت در طول دورهها و گروهها است.
شعاع اتمی
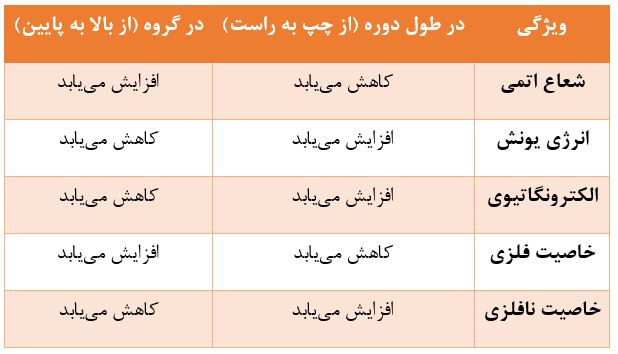
شعاع اتمی، که اندازهای از اندازه اتم است، در طول یک دوره از چپ به راست کاهش مییابد و در طول یک گروه از بالا به پایین افزایش مییابد. افزایش بار هستهای در طول یک دوره، الکترونها را به هسته نزدیکتر میکند و باعث کاهش اندازه اتم میشود. از طرف دیگر، اضافه شدن لایههای الکترونی در پایین یک گروه، اندازه اتم را افزایش میدهد.
انرژی یونش
انرژی یونش، که انرژی مورد نیاز برای حذف یک الکترون از یک اتم گازی است، در طول یک دوره از چپ به راست افزایش مییابد و در طول یک گروه از بالا به پایین کاهش مییابد. افزایش جاذبه هستهای در طول یک دوره، حذف الکترون را دشوارتر میکند. در پایین یک گروه، افزایش فاصله الکترون از هسته و اثر پوشانندگی لایههای داخلی، حذف الکترون را آسانتر میکند.
الکترونگاتیوی
الکترونگاتیوی، که توانایی یک اتم برای جذب الکترونها در یک پیوند شیمیایی است، در طول یک دوره از چپ به راست افزایش مییابد و در طول یک گروه از بالا به پایین کاهش مییابد. نافلزات در سمت راست جدول تمایل بیشتری به جذب الکترون دارند. در پایین یک گروه، با افزایش اندازه اتم، قدرت جاذبه هسته برای الکترونهای پیوندی کاهش مییابد.
خاصیت فلزی و نافلزی
خاصیت فلزی، که توانایی یک عنصر برای از دست دادن الکترون است، در طول یک دوره از چپ به راست کاهش مییابد و در طول یک گروه از بالا به پایین افزایش مییابد. خاصیت نافلزی، که توانایی یک عنصر برای گرفتن الکترون است، روند معکوسی را نشان میدهد: افزایش از چپ به راست و کاهش از بالا به پایین. این روندها مستقیماً با توانایی اتمها برای از دست دادن یا به دست آوردن الکترون مرتبط هستند.
جدول زیر خلاصه ای از روندهای تناوبی کلیدی را ارائه میدهد:
اهمیت و کاربردهای جدول تناوبی در علم شیمی و فراتر از آن
جدول تناوبی یک ابزار بینهایت ارزشمند در علم شیمی است و کاربردهای آن بسیار فراتر از این حوزه گسترش مییابد. این جدول نقش مهمی در پیشبینی خواص عناصر و ترکیبات شیمیایی ایفا میکند. با درک روندهای تناوبی، دانشمندان میتوانند خواص عناصری که هنوز کشف نشدهاند را تخمین بزنند و رفتار عناصر شناخته شده را در شرایط مختلف پیشبینی کنند.
علاوه بر این، جدول تناوبی در درک واکنشهای شیمیایی و پیوندها نقش اساسی دارد. سازماندهی عناصر بر اساس آرایش الکترونی و الکترونگاتیوی به توضیح اینکه چرا عناصر خاص به روشهای خاصی واکنش نشان میدهند و انواع خاصی از پیوندهای شیمیایی را تشکیل میدهند، کمک میکند.
اهمیت جدول تناوبی در تحقیقات علمی، صنایع دارویی، مواد و فناوری نیز بسیار زیاد است. سازماندهی عناصر در این جدول برای طراحی مواد جدید با خواص مطلوب، توسعه داروها و پیشرفت در کاربردهای مختلف فناوری حیاتی است. برای مثال، شناخت خواص اکتینیدها به استفاده از آنها در ضربانسازهای قلب و نیروگاههای هستهای منجر شده است. همچنین، درک خواص نیمهرسانایی شبهفلزات، انقلاب در صنعت الکترونیک را رقم زده است.
راهنمای یادگیری جدول تناوبی
یادگیری جدول تناوبی، این ابزار قدرتمند شیمی، سفری اکتشافی به دنیای عناصر سازنده ماده است. برای آغاز این سفر، داشتن یک راهنمای جامع و روشمند ضروری است. اولین قدم، آشنایی با ساختار کلی جدول است. جدول تناوبی از ردیفهای افقی به نام دورهها و ستونهای عمودی به نام گروهها تشکیل شده است.
هر خانه در این جدول، نشاندهنده یک عنصر شیمیایی با ویژگیهای منحصر به فرد است. درک این ساختار اولیه به شما کمک میکند تا منطق سازماندهی عناصر را دریابید. به خاطر سپردن گروههای اصلی، مانند فلزات قلیایی، فلزات قلیایی خاکی، هالوژنها و گازهای نجیب، به عنوان نقاط مرجع، میتواند مسیر یادگیری را هموارتر سازد.
پس از آشنایی با ساختار کلی، تمرکز بر درک روند تغییرات خواص عناصر در طول گروهها و دورهها اهمیت پیدا میکند. به جای تلاش برای حفظ کردن ویژگیهای تک تک عناصر، به دنبال الگوها باشید. برای مثال، در یک گروه، واکنشپذیری فلزات معمولاً با پایین رفتن افزایش مییابد، در حالی که در یک دوره، الکترونگاتیوی اغلب از چپ به راست افزایش مییابد.
درک این روندها به شما امکان میدهد تا خواص یک عنصر را با توجه به موقعیت آن در جدول پیشبینی کنید. استفاده از جدولهای رنگی که فلزات، نافلزات و شبهفلزات را با رنگهای متفاوت نشان میدهند، میتواند به تجسم این دستهبندیها و درک تفاوتهای اساسی بین آنها کمک کند.
در نهایت، تسلط بر نمادهای شیمیایی عناصر و نام آنها یک گام اساسی در یادگیری جدول تناوبی است. این نمادها زبان بینالمللی شیمی هستند و برای درک واکنشهای شیمیایی و فرمولهای ترکیبات ضروریاند.
استفاده از فلشکارتها، نرمافزارهای آموزشی تعاملی و تمرینهای مکرر میتواند به تقویت حافظه در این زمینه کمک کند. همچنین، بهرهگیری از منابع آموزشی متنوع، از کتابهای درسی گرفته تا وبسایتهای علمی و ویدیوهای آموزشی، میتواند زوایای مختلف جدول تناوبی را برای شما روشن سازد و یادگیری را جذابتر کند. به یاد داشته باشید که یادگیری جدول تناوبی یک فرآیند تدریجی است و با صبر و پشتکار میتوان به تسلط بر آن دست یافت.

پرسشهای متداول در مورد جدول تناوبی
- جدول تناوبی چند عنصر دارد؟ در حال حاضر، جدول تناوبی شامل ۱۱۸ عنصر شناسایی شده است.
- چه کسی جدول تناوبی را اختراع کرد؟ دیمیتری مندلیف به طور گسترده به عنوان بنیانگذار جدول تناوبی مدرن شناخته میشود، اگرچه تلاشهای دیگری نیز پیش از او صورت گرفته بود.
- چرا جدول تناوبی مهم است؟ جدول تناوبی به عنوان یک چارچوب اساسی برای درک خواص عناصر، پیشبینی رفتار آنها و سازماندهی دانش شیمی عمل میکند.
- چگونه میتوان جدول تناوبی را یاد گرفت؟ استفاده از جدول رنگی، تمرکز بر گروههای اصلی، یادگیری روند تغییرات خواص و استفاده از نمادهای شیمیایی از جمله روشهای موثر برای یادگیری جدول تناوبی هستند.
نتیجهگیری
سازماندهی دانش ما از عناصر و پیشرفتهای علمی در زمینههای مختلف ایفا کرده است. درک جدول تناوبی برای هر کسی که به علم شیمی و دنیای اطراف خود علاقهمند است، ضروری است.
در پایان این بررسی، آشکار میشود که جدول تناوبی عناصر فراتر از یک فهرست ساده از مواد شیمیایی است. این جدول، یک نقشه راه جامع برای درک بنیادین ساختار و رفتار ماده در جهان ما به شمار میرود. تکامل تاریخی این جدول، از تلاشهای اولیهی دانشمندان برای یافتن نظم در میان عناصر شناختهشده تا شکل امروزی آن، گواهی بر قدرت مشاهده، طبقهبندی و جستجوی الگو در علم است.
ساختار هوشمندانه جدول، با گروهها و دورههای خود، نه تنها عناصر را بر اساس خواص مشابه سازماندهی میکند، بلکه روندهای قابل پیشبینی در ویژگیهای آنها را نیز آشکار میسازد. این سازماندهی منطقی، جدول تناوبی را به ابزاری بینظیر برای پیشبینی رفتار شیمیایی عناصر و طراحی آزمایشها تبدیل کرده است.
اهمیت جدول تناوبی در پیشرفتهای علمی و فناوری در زمینههای گوناگون غیرقابل انکار است. از توسعه مواد جدید با خواص منحصربهفرد گرفته تا درک واکنشهای بیولوژیکی پیچیده در بدن موجودات زنده، جدول تناوبی به عنوان یک چارچوب اساسی برای درک و دستکاری جهان در سطح اتمی عمل میکند.
شیمیدانان، فیزیکدانان، زیستشناسان و مهندسان همگی از این ابزار قدرتمند برای پیشبرد تحقیقات خود و حل چالشهای علمی و صنعتی بهره میبرند. بدون درک عمیق از جدول تناوبی و روابط بین عناصر، بسیاری از اکتشافات و نوآوریهای مدرن امکانپذیر نبودند.
در نهایت، درک جدول تناوبی برای هر فردی که کنجکاو دربارهی دنیای اطراف خود و اصول اساسی آن است، یک ضرورت محسوب میشود. این جدول نه تنها دریچهای به دنیای شگفتانگیز شیمی میگشاید، بلکه به ما کمک میکند تا ارتباطات عمیق بین مواد مختلف و نقش آنها در زندگی روزمره را درک کنیم.
از عناصر سازنده بدن ما گرفته تا موادی که در فناوریهای پیشرفته به کار میروند، همه در این جدول سازماندهی شدهاند. بنابراین، یادگیری و درک جدول تناوبی، گامی مهم در جهت کسب سواد علمی و قدردانی از پیچیدگی و زیبایی جهان مادی است.